Benzen là gì? Tìm hiểu kiến thức về benzen và các bài tập hóa học
- Bất đồng quan điểm là gì? Cách xử lý khéo léo khi bất đồng quan điểm
- Chứng chỉ CO CQ là gì? Tại sao xuất nhập khẩu hàng hóa yêu cầu phải có CO CQ
- Truyện ngụ ngôn là gì? Đặc điểm, ý nghĩa, ví dụ truyện ngụ ngôn
- Karma là gì? 12 quy luật nhân quả của Karma mà bạn nên biết
- Nước vôi trong là gì? Cách làm và lưu ý khi dùng nước vôi trong
Benzen, một trong những chủ đề quan trọng trong môn hóa học ở trình độ Trung học phổ thông, luôn thu hút sự quan tâm của học sinh. Vòng benzen, tính chất hóa học, cách tổng hợp và ứng dụng của benzen đều là những vấn đề được đặt ra. Là Gì Nhỉ mang đến cho bạn cái nhìn tổng quan về benzen hóa 9 và các thông tin liên quan.
Bạn đang xem: Benzen là gì? Tổng hợp kiến thức benzen hóa 9 và Các dạng bài tập
Chúng ta sẽ cùng khám phá về benzen, một phần quan trọng không thể bỏ qua trong học hóa học. Bài viết sau đây sẽ đồng hành cùng bạn đào sâu vào thế giới của benzen hóa 9 và giải đáp mọi thắc mắc xung quanh chủ đề này!
Benzen là gì?
Theo định nghĩa, Benzen là một hợp chất hóa học có công thức là C₆H₆. Được biết đến như một hydrocarbon thơm, Benzen ở điều kiện bình thường tồn tại dưới dạng một chất lỏng không màu và dễ cháy. Tính chất đặc trưng của Benzen là khả năng khó tan trong nước và cũng khó tan trong rượu.
Cấu Trúc Molecul Benzen
Theo phân tích quang phổ, góc liên kết giữa các nguyên tử trong benzen đều là 120 độ, độ dài liên kết C-C đồng đều (140 pm), lớn hơn so với liên kết đôi nhưng nhỏ hơn so với liên kết đơn (136 pm và 147 pm). Cấu trúc phân tử benzen được giải thích thông qua thuyết lai hóa obitan. Có hai cách biểu diễn cấu tạo của benzen như sau:
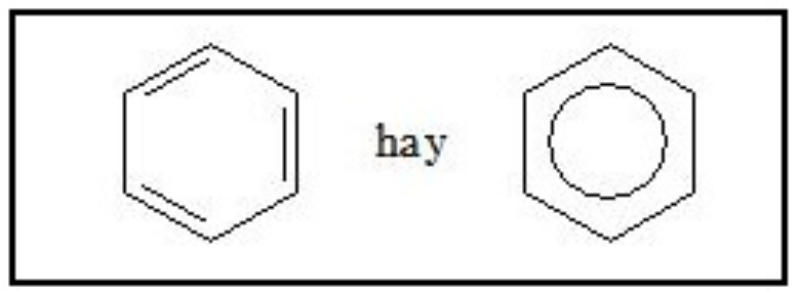
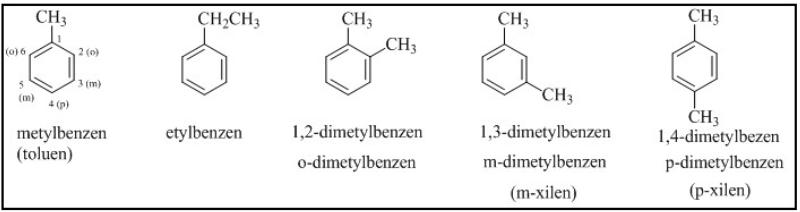
Đồng đẳng, đồng phân và danh pháp của benzen
Khi thay thay các nguyên tử hiđro trong phân tử benzen (𝐶6𝐻6) bằng các nhóm ankyl, bạn sẽ thu được các ankylbenzen, có công thức chung là 𝐶𝑛𝐻2𝑛−6 với 𝑛≥6.
Ví dụ :
- 𝐶6𝐻5−𝐶𝐻3;
- 𝐶6𝐻5−𝐶𝐻2−𝐶𝐻3;
- 𝐶6𝐻5−𝐶𝐻2−𝐶𝐻2−𝐶𝐻3.
Xem thêm : Blogspot là gì? Cách tạo Blogspot miễn phí chỉ với 7 bước
Khi coi vòng benzen là mạch chính, các nhóm ankyl đính vào nó được xem như mạch nhánh (còn được biết đến với tên gọi khác là nhóm thế). Ankylbenzen có đồng phân mạch cacbon. Để đặt tên cho chúng, bạn cần chỉ rõ vị trí các nguyên tử C của vòng bằng các chữ số hoặc các chữ cái o, m, p (đọc là ortho, meta, para).
Tính chất vật lý của benzen
Benzen và ankylbenzen là những chất không màu, hầu như không tan trong nước nhưng tan trong nhiều dung môi hữu cơ, đồng thời cũng là dung môi hoà tan nhiều chất khác. Các aren (benzen và ankylbenzen) đều là những chất có mùi. Chẳng hạn như benzen và toluen có mùi thơm nhẹ, nhưng có hại cho sức khoẻ, nhất là benzen.
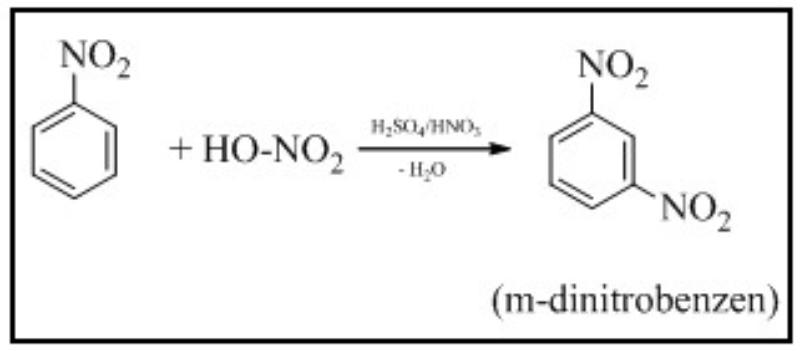
Phản ứng nitro hóa
Benzen tương tác với hỗn hợp 𝐻𝑁𝑂3 đặc và 𝐻2𝑆𝑂4 đậm đặc để tạo thành nitrobenzen:
Nitrobenzen tương tác với hỗn hợp axit 𝐻𝑁𝑂3 bốc khói và 𝐻2𝑆𝑂4 đặc đồng thời đun nóng sẽ hình thành m-đinitrobenzen.
Toluen tham gia phản ứng nitro hóa dễ dàng hơn benzen và tạo thành sản phẩm thay vào vị trí ortho và para:
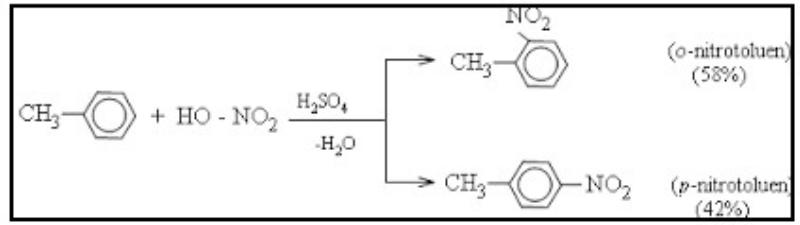
Quy luật thế ở vòng benzen
- Nếu vòng benzen đã chứa các nhóm −𝐶𝐻3, −𝑂𝐻, −𝑁𝐻2, −𝑂𝐶𝐻3…, phản ứng thay vào vòng sẽ dễ dàng hơn và ưu tiên xảy ra ở vị trí ortho và para.
- Nếu trong vòng benzen đã có nhóm −𝑁𝑂2 (hoặc các nhóm −𝐶𝑂𝑂𝐻, −𝑆𝑂3𝐻, −𝐶𝐻𝑂…) phản ứng thay vào vòng sẽ khó hơn và ưu tiên xảy ra ở vị trí meta.
Phản ứng cộng
- Benzen và ankylbenzen không gây mất màu dung dịch brom (không thể cộng với brom).
- Benzen cộng với clo khi chiếu sáng:
𝐶6𝐻6+3𝐶𝑙2→𝑎𝑠𝐶6𝐻6𝐶𝑙6
- Benzen và ankylbenzen cộng với hiđro tạo thành xicloankan:
𝐶6𝐻6+3𝐻2→𝑁𝑖,𝑡∘𝐶6𝐻12
Phản ứng oxi hóa
- Benzen không phản ứng với 𝐾𝑀𝑛𝑂4 (không làm mất màu dung dịch 𝐾𝑀𝑛𝑂4).
- Các ankylbenzen khi được đun nóng với dung dịch 𝐾𝑀𝑛𝑂4 chỉ có nhóm ankyl bị oxi hóa.
Ví dụ:
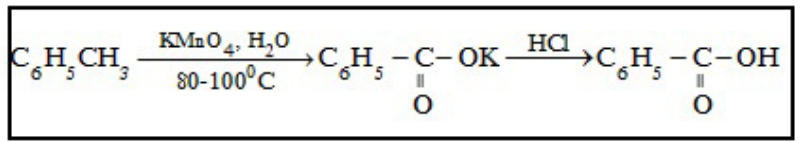
- Các aren khi đốt trong không khí thường tạo ra nhiều tro. Khi cháy hoàn toàn, chúng tạo ra 𝐶𝑂2,𝐻2𝑂 và phát ra nhiều nhiệt.
𝐶6𝐻6+152𝑂2→6𝐶𝑂2+3𝐻2𝑂(Δ𝐻=−3273𝑘𝐽)
Nhận xét: Benzen tương đối dễ tham gia vào phản ứng thế, khó tham gia vào phản ứng cộng và bền vững trước các chất oxi hóa. Điều này cũng là đặc điểm hóa học chung của các hydrocacbon thơm nên được gọi là tính chất thơm.
Ứng dụng của benzen
Benzen đóng vai trò quan trọng trong việc tổng hợp các monome khi sản xuất các loại polime như chất dẻo, cao su, và tơ sợi. Từ benzen, chúng ta có thể sản xuất nitrobenzen, anilin, và phenol – các hợp chất cần thiết cho việc tổng hợp phẩm nhuộm, dược phẩm, và thuốc trừ dịch hại.
Toluen được sử dụng rộng rãi trong việc sản xuất chất nổ TNT (trinitrotoluen).
Ngoài ra, benzen, toluen, và các xilen cũng được sử dụng phổ biến như các dung môi hóa học.Trong lĩnh vực hóa học Trung học phổ thông, kiến thức về Benzen đóng vai trò quan trọng. Vòng Benzen là một chủ đề thu hút sự quan tâm của nhiều học sinh. Vậy “Vòng Benzen” thực sự là gì? Benzen có những tính chất hóa học như thế nào? Làm thế nào để điều chế Benzen và ứng dụng Benzen ra sao? Cách giải các bài tập liên quan đến Benzen ở lớp 9 như thế nào? Trên trang của chúng tôi, hãy cùng tìm hiểu về chủ đề Benzen ở lớp 9 và các thông tin liên quan!
Câu hỏi thường gặp
- Benzen là gì?
- Cấu trúc phân tử của Benzen như thế nào?
- Đồng đẳng, đồng phân và danh pháp của Benzen là gì?
- Benzen có những tính chất vật lý nào?
- Tính chất hóa học của Benzen ở lớp 9 bao gồm những gì?
- Điều chế Benzen như thế nào?
- Ứng dụng của Benzen là gì?
- Những sản phẩm nào có / gốc từ Benzen?
- Làm thế nào để phân biệt Benzen, hex-1-en và Toluene?
- Phương trình hoá học của các phản ứng liên quan?
- Giải phương trình hóa học cho hiđrocacbon X?
- Các bài tập về Benzen ở lớp 9 bao gồm những yêu cầu nào?
Tóm tắt
Trên toàn bài viết này, chúng tôi đã cung cấp kiến thức chi tiết về Benzen ở cấp học phổ thông. Từ định nghĩa, cấu trúc phân tử, đồng đẳng và đồng phân, đến tính chất vật lý và hóa học của Benzen, chúng tôi không chỉ giúp bạn hiểu rõ về chủ đề này mà còn cung cấp các bài tập và ví dụ minh họa. Để tìm hiểu thêm về Benzen và các ứng dụng thực tiễn, hãy truy cập trang web của chúng tôi ngay hôm nay!
Nguồn: https://laginhi.com
Danh mục: News

