Hidro sunfua là gì? Một thế giới bí ẩn về Hiđro sunfua và muối sunfua sẽ được hé lộ tại LagiNhi. Bạn đã bao giờ tò mò về “Hidro sunfua” chưa? Bài viết này sẽ là chìa khóa mở ra những điều thú vị về Hiđro sunfua và muối sunfua mà bạn không nên bỏ qua. Chúng ta sẽ cùng nhau khám phá lý thuyết, bài tập, cách nhận biết, tính chất, ứng dụng và cách điều chế của Hidro sunfua. Đừng bỏ lỡ cơ hội khám phá cùng LagiNhi.com!
Hiện Tượng Hidro Sunfua
Hiđro sunfua là loại khí không màu, có mùi hắc như trứng thối, cực kỳ đặc biệt với trọng lượng lớn hơn không khí (d=3429 ≈ 1,17 lần).
Bạn đang xem: Hidro sunfua là gì? Chuyên đề Hiđro sunfua và muối sunfua
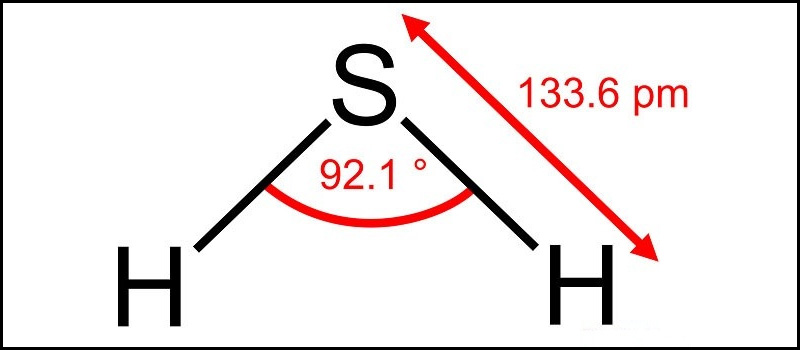
Tính chất vật lý của hidro sunfua
- Hidro sunfua khi hóa lỏng có thể xảy ra ở nhiệt độ -60 độ C và khi hóa rắn xảy ra ở -86 độ C.
- Độ tan của khí H2S trong nước ở điều kiện 20 độ C và 1atm là 0,38g/100g H2O.
- Khí H2S là chất độc, ngay cả lượng nhỏ trong không khí cũng có thể gây ra ngộ độc nghiêm trọng cho con người và động vật.

Tính axit yếu
- Việc hiđro sunfua hòa tan trong nước tạo thành dung dịch axit với độ axit rất yếu (thấp hơn so với axit cacbonic), được biết đến với tên gọi là axit sunfuhiđric (H2S).
- Axit sunfuhiđric phản ứng với chất kiềm tạo ra hai dạng muối: muối trung hòa như Na2S chứa ion S2− và muối axit như NaHS chứa ion HS−.
Khi hiđro sunfua hòa tan vào nước, nó tạo ra axit sunfuhiđric, một loại axit khá yếu so với các loại axit khác. Axit sunfuhiđric có khả năng tương tác với chất kiềm để tạo thành các dạng muối khác nhau, bao gồm muối trung hòa như Na2S với ion S2− và muối axit như NaHS với ion HS−. Điều này làm nổi bật tính chất axit yếu của hiđro sunfua trong môi trường nước.
Tính khử mạnh
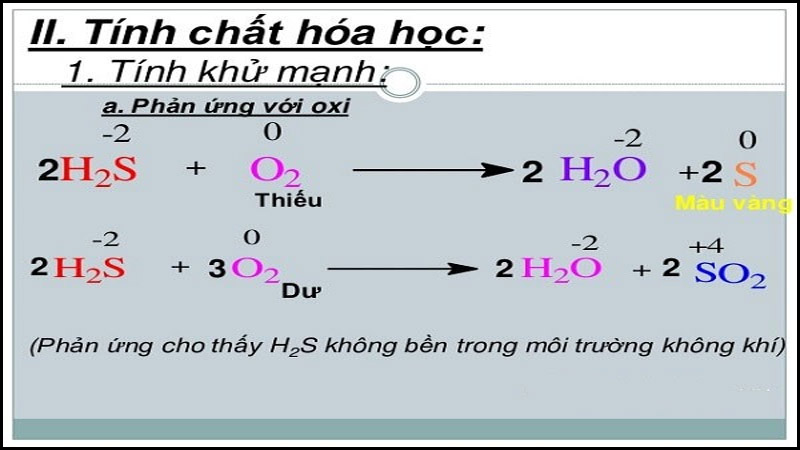
Trong phân tử H2S, lưu huỳnh có số oxi hóa thấp nhất là -2. Trong quá trình phản ứng hóa học, lưu huỳnh có thể bị chuyển từ trạng thái -2 (S−2) sang lưu huỳnh tự do (S0), hoặc +4 (S+4), hoặc +6 (S+6). Do đó, hidro sunfua thể hiện tính khử mạnh.
- Hidro sunfua phản ứng với oxi:
- Khi dung dịch axit sunfuhiđric tiếp xúc với không khí, nó sẽ trở nên đục và màu vàng do oxi của không khí oxi hóa H2S thành S0.
2H2S+O2→2H2O+2S
- Ở nhiệt độ cao, khí H2S cháy trong không khí tạo ra ngọn lửa xanh nhạt, H2S bị oxi hóa thành SO2.
2H2S+3O2→t∘2H2O+2S+4O2
- Nếu không có đủ không khí hoặc ở nhiệt độ thấp, H2S sẽ bị oxi hóa thành S0.
2H2S+O2→t∘H2O+2S
- Clo có khả năng oxi hóa H2S thành H2SO4:
H2S+4Cl2+4H2O→H2SO4+8HCl
H2S khô không tác dụng với Cu, Ag, Hg, tuy nhiên khi có hơi nước thì phản ứng xảy ra nhanh chóng, làm cho bề mặt kim loại trở nên xám.
4Ag+2H2S+O2→2Ag2S+2H2O
Trạng thái tự nhiên của hidro sunfua
Trong môi trường tự nhiên, hidro sunfua xuất hiện trong một số / nước suối, khí từ núi lửa, cũng như khí phát ra từ quá trình phân hủy protein…
Cách điều chế hidro sunfua
Trong lĩnh vực công nghiệp, không có quy trình sản xuất hidro sunfua.
Trong môi trường thí nghiệm, hidro sunfua có thể được tạo ra thông qua phản ứng giữa dung dịch axit clohiđric và sắt (II) sunfua như sau:
| FeS + 2HCl → FeCl2 + H2S |
Nội dung trên giải thích quy trình chuẩn bị hidro sunfua trong môi trường phòng thí nghiệm thông qua phản ứng đơn giản giữa FeS và axit clohiđric, tạo ra FeCl2 và H2S. Điều này thể hiện sự quan trọng của việc hiểu rõ các phản ứng hóa học cơ bản, đặc biệt đối với các ứng dụng trong lĩnh vực công nghiệp và nghiên cứu. Hãy cẩn thận và chính xác khi thực hiện các bước này để đạt được kết quả mong muốn và đảm bảo an toàn trong quá trình thí nghiệm.
Cách xác định hidro sunfua
- Có mùi như trứng thối.
- Chuyển màu dung dịch Pb(NO3)2 và Cu(NO3)2 thành đen.
Xem thêm : SPF là gì? Các chỉ số SPF trong kem chống nắng
Kết quả phản ứng:
Pb(NO33)2 + H2S → PbS + 2HNO3
Cu(NO33)2 + H2S → CuS + 2HNO3
- Làm mất màu dung dịch Brom, dung dịch KMnO4,…
Tính chất vật lí của lưu huỳnh đioxit
Lưu huỳnh đioxit là một loại chất khí không màu, có trọng lượng cao hơn không khí, phát ra mùi khó chịu, có độc tính cao, có khả năng tan trong nước và tương tác với nước.
Tính chất hóa học của lưu huỳnh đioxit
Lưu huỳnh đioxit (SO2) là oxit axit. Khi tác dụng với nước, SO2 tạo thành axit sunfuơnit với phản ứng: SO2 + H2O ↔ H2SO3.
Khi tương tác với dung dịch bazơ, SO2 có thể tạo ra hai loại muối là sunfit và hiđrosunfit. Ví dụ: SO2 + NaOH → NaHSO3 và SO2 + 2NaOH → Na2SO3 + H2O.
Đồng thời, SO2 còn tác dụng với oxit bazơ để tạo thành muối, ví dụ: SO2 + CaO → CaSO3.
SO2 đồng thời cũng là chất khử và chất oxi hóa vì sulfua (S) trong SO2 có mức oxi hóa trung gian +4. SO2 có thể hoạt động như chất oxi hóa trong phản ứng: SO2 + 2H2S → 3S + 2H2O, và đồng thời là chất khử trong phản ứng: 2SO2 + O2 ↔ 2SO3. Ngoài ra, SO2 còn tham gia vào phản ứng Cl2 + SO2 + 2H2O → H2SO4 + 2HCl.
Điều chế lưu huỳnh đioxit
- Đốt cháy lưu huỳnh:
Khi lưu huỳnh được đốt cháy trong không khí, phản ứng xảy ra theo phương trình:
S + O2 → t∘ SO2
- Đốt cháy H2S trong oxi dư:
<p Khi khí hidro sunfua (H2S) được đốt trong môi trường chứa đủ oxi, ta thu được nước và khí lưu huỳnh đioxit theo phương trình:
2H2S + 3O2 → 2H2O + 2SO2
- Cho kim loại tác dụng với HNO3:
<p Khi kim loại phản ứng với axit nitric, chúng tạo ra muối nitrat của kim loại đó, khí nitơ dioxide và nước theo phương trình:
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
- Đốt quặng:
<p Khi quặng sắt pyrit được đốt cháy trong không khí, quặng sẽ chuyển hóa thành oxit sắt và khí lưu huỳnh đioxit theo phương trình:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
- Trong phòng thí nghiệm dùng phản ứng của Na2SO3 với dung dịch H2SO4:
<p Khi natri sunfit phản ứng với axit sunfuric, ta thu được natri sunfat, khí lưu huỳnh đioxit và nước theo phương trình:
Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O
Nhận biết lưu huỳnh đioxit
- Biến quỳ tím ẩm thành màu đỏ.
- Làm mất màu dung dịch nước brom, dung dịch thuốc tím…
SO2+2H2O+Br2→ 2HBr+H2SO4
- Ứng dụng của lưu huỳnh đioxit
- Sản xuất axit sunfuric.
- Tẩy trắng giấy, bột giấy.
- Chống nấm mốc cho lương thực, thực phẩm.
Xem thêm : Check VAR là gì? Trend Check VAR là gì trên Facebook, TikTok
Lưu ý: Ngoài các ứng dụng trên, SO2 còn tạo ra ô nhiễm môi trường và gây hiện tượng mưa axit.
Tính chất của lưu huỳnh Trioxit
- Lưu huỳnh trioxit (SO3) là một chất lỏng không màu tan vô hạn trong nước và axit sunfuaric. Lưu trioxit là một loại oxit axit.
- Chất này có tác dụng mạnh mẽ với nước, tạo thành axit sunfuaric theo phương trình: SO3 + H2O → H2SO4
- Lưu huỳnh trioxit cũng tác dụng với dung dịch bazo và oxit bazo tạo ra các muối sunfat.
Hidro sunfua và Muối sunfua: Tính chất và Ứng dụng
Câu hỏi thường gặp
-
Hidro sunfua là gì?
- Hiđro sunfua là khí không màu, mùi trứng thối, nặng hơn không khí.
-
Tính chất vật lý của hidro sunfua?
- Hóa lỏng ở −60∘C, hóa rắn ở −86∘C và có độ tan S = 0,38g/100g H2O.
-
Tính chất hóa học của hidro sunfua?
- Hiđro sunfua tan trong nước tạo thành dung dịch axit rất yếu và có tính khử mạnh.
-
Trạng thái tự nhiên và điều chế hidro sunfua?
- Hiđro sunfua tồn tại trong nước suối và khí núi lửa, không được sản xuất trong công nghiệp.
-
Cách nhận biết hidro sunfua?
- Mùi trứng thối và làm đen dung dịch Pb(NO3)2 và Cu(NO3)2.
-
Lưu huỳnh đioxit – SO2: Tính chất và Ứng dụng?
- SO2 là chất khí không màu, độc, tác dụng với nước và được sử dụng trong sản xuất axit sunfuric.
-
Cách nhận biết và điều chế lưu huỳnh đioxit?
- Làm quỳ tím ẩm chuyển màu đỏ, và tác dụng của SO2 bao gồm tẩy trắng giấy và chống nấm mốc.
-
Lưu huỳnh Trioxit – SO3: Tính chất và Ứng dụng?
- SO3 là chất lỏng không màu tan vô hạn trong nước, tác dụng mạnh với nước để tạo ra axit sunfuaric.
Tóm tắt
Trên đây là những thông tin cơ bản về hidro sunfua và muối sunfua, từ tính chất đến ứng dụng. Để biết thêm chi tiết, hãy thăm trang web của chúng tôi.
Hãy khám phá thêm thông tin và áp dụng kiến thức vào thực tế để hiểu rõ hơn về hidro sunfua và muối sunfua. Chúc bạn học tốt!
Nguồn: https://laginhi.com
Danh mục: News
