Được xem xét trong chương trình hóa học 10, nhóm Halogen chính là chủ đề số 21. Vậy thì, halogen là cái gì đáng chú ý? Bạn cần hiểu rõ kiến thức cơ bản nào về nhóm halogen? Hãy tìm hiểu về vị trí và điểm đặc trưng của nhóm này… Trong bài viết dưới đây của Laginhi.com, chúng ta sẽ cùng nhau khám phá về nhóm Halogen và những điều thú vị xung quanh nó!
Halogen là gì? Lý thuyết về Halogen
Halogen là những nguyên tố phi kim trong nhóm VIIA của bảng tuần hoàn hóa học. Đây là các nguyên tố có vị trí cuối cùng trong chuỗi, liền trước các nguyên tố khí hiếm. Điều đặc biệt về halogen đó là chúng có 7 electron ở lớp ngoài cùng.
Bạn đang xem: Halogen là gì? Tìm hiểu lý thuyết và bài tập nhóm halogen
Vị Trí của Nhóm Halogen trong Bảng Tuần Hoàn
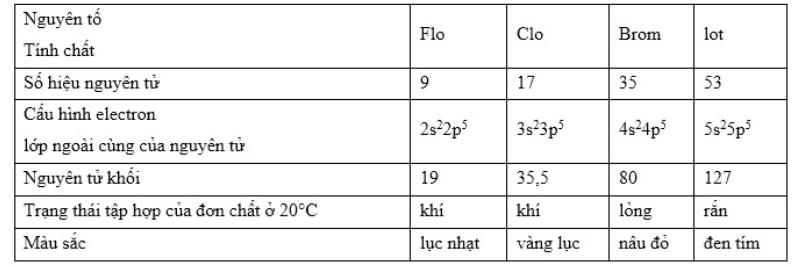
Nhóm halogen bao gồm các nguyên tố flo (F), clo (Cl), brom (Br), iot (I), và atatin (At). Atatin, mặc dù không tồn tại tự nhiên, nhưng lại được sản xuất nhân tạo trong các lò phản ứng hạt nhân và thường được xem xét chủ yếu trong nhóm các nguyên tố phóng xạ.
Các nguyên tố halogen thuộc nhóm VIIA, đặt ở vị trí cuối cùng của chuỗi nguyên tố và ngay trước các nguyên tố khí hiếm.
Cấu hình Electron và Cấu Tạo Phân Tử của Nhóm Halogen
Lớp electron ngoài cùng của các nguyên tử halogen đều chứa 7 electron, được chia thành 2 phân lớp: phân lớp s với 2 electron và phân lớp p với 5 electron (𝑛𝑠2𝑛𝑝5). Với việc có đúng 7 electron ở lớp ngoài cùng, chỉ cần 1 electron nữa để đạt được cấu hình electron ổn định giống như khí hiếm. Do đó, trong trạng thái tự do, hai nguyên tử halogen sẽ chia sẻ một cặp electron để tạo ra phân tử kết hợp không phân cực.
Liên kết trong phân tử 𝑋2 không ổn định và dễ bị tách ra thành hai nguyên tử X. Trong các phản ứng hoá học, các nguyên tử này rất phản ứng lên vì dễ nhận thêm một electron, do đó tính chất hoá học cơ bản của halogen là khả năng oxi hóa mạnh.
Tính chất vật lí của nhóm Halogen là gì?
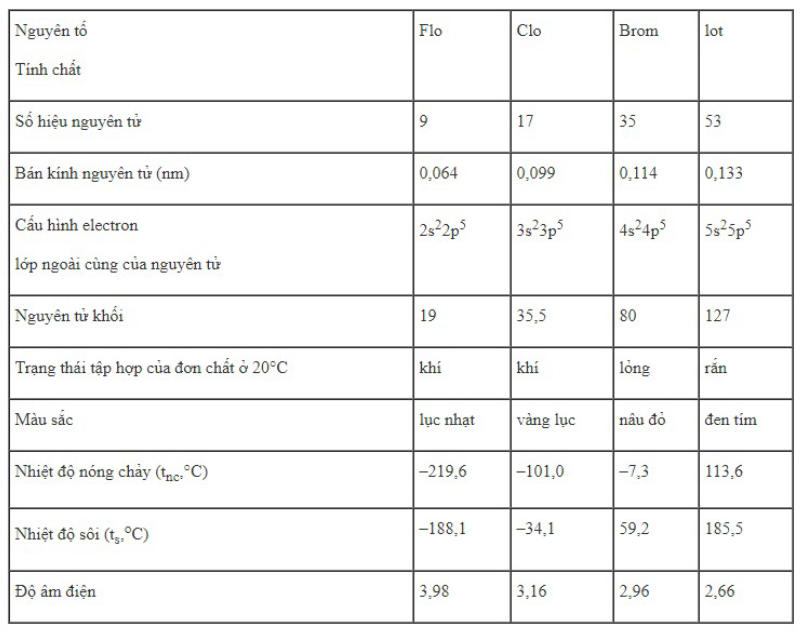
- Halogen bao gồm Flo (khí, màu lục nhạt), Clo (khí, màu vàng lục), Brom (lỏng, màu đỏ nâu) và Iot (rắn, màu đen tím và dễ thăng hoa).
- Từ Flo đến Iot, nhiệt độ nóng chảy và sôi của nhóm Halogen tăng dần.
- Flo không tan trong nước, các loại halogen khác tan ít trong nước và tan nhiều trong một số dung môi hữu cơ.
Nhóm Halogen gồm fluor (F), clo (Cl), brom (Br), và iốt (I) có những tính chất hóa học đặc trưng. Với lớp electron ngoài cùng đạt 7 electron, halogen thường được coi là phi kim và có khả năng tăng thêm 1 electron để thể hiện tính chất oxi hóa mạnh. Tính oxi hóa của halogen giảm dần từ F2 đến I2. Trong các hợp chất, fluor chỉ có mức oxi hóa -1, trong khi các loại halogen khác có thể có mức oxi hóa từ -1 đến +7. Điều này thể hiện sự đa dạng và tính chất đặc biệt của nhóm Halogen trong bảng tuần hoàn nguyên tố.
Hãy nhìn qua hình ảnh dưới đây để hiểu rõ hơn về tính chất của nhóm Halogen:
- Đặc điểm: Nhóm Halogen gồm fluor, clo, brom và iốt.
- Tính chất hóa học: Halogen được xem là phi kim và có khả năng oxi hóa mạnh.
- Sự đa dạng: Tính oxi hóa của halogen giảm từ F đến I, với các mức oxi hóa khác nhau trong các hợp chất.
Hình ảnh minh họa từ bài viết sẽ giúp bạn hình dung rõ hơn về tính chất của nhóm Halogen.
Mô tả đặc điểm của nhóm halogen
Để hiểu rõ hơn về nhóm halogen, bạn cần am hiểu về một số đặc điểm cơ bản của các nguyên tố trong nhóm này như sau:
Các Đặc Điểm Chính:
- Tính chất hóa học: Nhóm halogen bao gồm các nguyên tố rất phản ứng, tạo thành các hợp chất với nhiều nguyên tố khác.
- Trạng thái tự nhiên: Các nguyên tố trong nhóm halogen tồn tại ở trạng thái khí hoặc halogen dạng muối.
- Điểm sôi và điểm tan chảy: Các nguyên tố trong nhóm halogen có điểm sôi và điểm tan chảy thấp, dễ dàng chuyển từ trạng thái rắn sang trạng thái lỏng hoặc khí.
- Potassium chloride: Potassium chloride is a salt that is made up of potassium and chlorine. It is often used as a fertilizer, but can also be found in some foods as a substitute for regular table salt.
Ví dụ:
Một ví dụ phổ biến của halogen là clo, một nguyên tố quan trọng trong hóa học và công nghệ.
Sự Thay Đổi Về Tính Chất Vật Lý Của Các Đơn Chất
Xem thêm : Sở khanh là gì? Dấu hiệu nhận biết đàn ông sở khanh
Khi chuyển từ flo sang iot, bạn có thể quan sát những biến đổi sau:
- Về trạng thái tập hợp: Chuyển từ dạng khí sang dạng lỏng và rắn.
- Liên quan đến màu sắc: Ngày càng đậm.
- Đối với nhiệt độ nóng chảy và sôi: Tăng dần.
The Transformation of Electronegativity of Elements
- Halogens exhibit relatively high electronegativity.
- As you progress from fluorine to iodine, electronegativity gradually decreases.
- Fluorine possesses the highest electronegativity, thus, in all compounds, it only has an oxidation state of -1. Other halogens, besides the -1 oxidation state, can also have oxidation states of +1, +3, +5, and +7.
Sự Thay Đổi Về Tính Chất Hoá Học Của Các Đơn Chất
- Vì lớp electron ngoài cùng có cấu trúc tương tự nhau (𝑛𝑠2𝑛𝑝5), các đơn chất halogen chia sẻ tính chất hoá học và thành phần tương đương nhau.
- Halogen đại diện cho nhóm phi kim. Từ flo đến iot, tính oxi hóa giảm dần.
- Các đơn chất halogen oxi hóa kim loại tạo muối halogeniđua, oxi hóa khí hiđro tạo hợp chất khí hiđro halogeniđua không màu. Những khí này tan trong nước tạo dung dịch axit halogenhiđric.
Một số phương trình hóa học của nhóm halogen
- AgNO3 + NaCl → AgCl + NaNO3 (AgCl kết tủa màu trắng)
- AgNO3 + NaBr → AgBr + NaNO3 (AgBr kết tủa màu vàng nhạt)
- AgNO3 + NaI → AgI + NaNO3 (AgI kết tủa màu vàng đậm)
- Dùng AgNO3 để nhận biết muối F-, Cl-, Br-, I-.
Trong phần này, chúng ta sẽ tìm hiểu về một số phương trình hóa học của nhóm halogen. Bằng cách phản ứng với AgNO3, các halogen sẽ tạo ra các kết tủa có màu đặc trưng khác nhau. AgCl cho màu trắng, AgBr tạo ra màu vàng nhạt, và AgI tạo thành kết tủa màu vàng đậm. Sử dụng AgNO3 làm chất định danh, ta có thể phân biệt giữa các ion F-, Cl-, Br-, và I-. Điều này giúp xác định chính xác loại halogen có trong hợp chất hóa học một cách dễ dàng. Trải nghiệm quá trình học hóa học thú vị này và khám phá thêm về tính chất độc đáo của các nguyên tố halogen!
Các Phương Trình Cơ Bản
- 2Na + Cl2 → 2NaCl (Natri Clorua)
- 2Fe + 3Cl2 → 2FeCl3 (Sắt III Clorua)
- H2 + Cl2 → 2HCl (Hidro Clorua)
- H2 + Br2 → 2HBr
- H2 + F2 → 2HF
- 2Na + Br2 → 2NaBr
- Br2 + 2NaI → 2NaBr + I2
Khi nghiên cứu hóa học, việc hiểu và áp dụng các phương trình hóa học cơ bản là rất quan trọng. Các phương trình này thể hiện quá trình phản ứng giữa các chất và là nền tảng cho việc hiểu sâu hơn về sự tương tác của chúng. Việc biết cách sử dụng và giải quyết các phương trình này sẽ giúp bạn nắm vững kiến thức cơ bản về hóa học và áp dụng chúng vào thực tế một cách hiệu quả.
Nước Clo
Khi nước clo được tạo ra từ phản ứng giữa clo và nước, công thức hoá học của quá trình này là 𝐶𝑙2+𝐻2𝑂→𝐻𝐶𝑙+𝐻𝐶𝑙𝑂. Nước clo chính là thành phần quan trọng trong quá trình làm sạch nước và tiêu diệt vi khuẩn. Việc sử dụng nước clo đúng cách sẽ giúp bảo vệ sức khỏe và đảm bảo nước sạch cho mọi người.
Khi sử dụng nước clo, cần tuân thủ đúng liều lượng và cách sử dụng để đảm bảo an toàn. Ngoài ra, lưu ý không pha trộn nước clo với các chất khác để tránh tạo ra các chất độc hại. Việc hiểu rõ về tính chất và cách sử dụng đúng sẽ giúp tối ưu hiệu quả của nước clo trong việc bảo vệ sức khỏe và vệ sinh môi trường.
Ngoài việc sử dụng nước clo trong lĩnh vực làm sạch nước, nó cũng được áp dụng rộng rãi trong công nghiệp, y tế và nhiều lĩnh vực khác. Đó chính là lý do vì sao nước clo đóng vai trò quan trọng trong cuộc sống hàng ngày của chúng ta.
Clorua vôi
Quá trình Ca(OH)2 + Cl2 → CaOCl2 + H2O
Khi nói đến clorua vôi, chúng ta nghĩ ngay đến quá trình hóa học Ca(OH)2 + Cl2 → CaOCl2 + H2O. Đây là một phản ứng quan trọng trong việc sản xuất và sử dụng clorua vôi trong nhiều ngành công nghiệp khác nhau. Clorua vôi, hay còn được biết đến với tên gọi khác là clo nước apôxit, đóng vai trò quan trọng trong việc khử trùng và làm sạch nước. Ngoài ra, nó cũng được ứng dụng trong sản xuất giấy, xử lý nước thải và nhiều ứng dụng khác. Quá trình hóa học này giúp tạo ra CaOCl2, một chất khử trùng mạnh mẽ và hiệu quả.
Muối clorat
- The reaction of 3𝐶𝑙2 with 6𝐾𝑂𝐻 produces 5𝐾𝐶𝑙, 𝐾𝐶𝑙𝑂3, and 3𝐻2𝑂.
- When 2𝐴𝑙 reacts with 3𝐶𝑙2, it forms 2𝐴𝑙𝐶𝑙3.
Muối clorat là một chất rất phổ biến trong ngành hóa học với nhiều ứng dụng khác nhau. Phản ứng của 3𝐶𝑙2 với 6𝐾𝑂𝐻 tạo ra 5𝐾𝐶𝑙, 𝐾𝐶𝑙𝑂3, và 3𝐻2𝑂, trong khi khi 2𝐴𝑙 tác dụng với 3𝐶𝑙2, nó tạo ra 2𝐴𝑙𝐶𝑙3. Điều này cho thấy khả năng phản ứng đa dạng của muối clorat và vai trò quan trọng của nó trong các quá trình hóa học.Trong lịch sử, dung dịch nước Javen đã từng được sử dụng rộng rãi trong việc xử lý nước cứng. Dung dịch này được tạo ra thông qua phản ứng hóa học 2𝑁𝑎𝑂𝐻+𝐶𝑙2 → 𝑁𝑎𝐶𝑙+𝑁𝑎𝐶𝑙𝑂+𝐻2𝑂. Phản ứng này giúp loại bỏ các chất cứng như canxi và magiê khỏi nước, giúp cải thiện chất lượng nước sạch.
Đèn halogen là gì?
Đèn halogen là một loại bóng đèn sợi đốt, bên trong có một sợi vonfram được bọc kín trong một bóng đèn nhỏ chứa một hỗn hợp khí trơ và một ít chất halogen như iốt hoặc brôm. Sự kết hợp giữa khí halogen và sợi vonfram tạo ra một chu trình hóa học giúp bổ sung vonfram cho sợi đốt, gia tăng tuổi thọ và duy trì vỏ bóng đèn trong suốt. Điều này giúp đèn halogen hoạt động ở nhiệt độ cao hơn so với đèn thông thường, đồng thời tạo ra ánh sáng hiệu suất cao và nhiệt độ màu sắc tốt hơn.
Đặc điểm của đèn halogen là kích thước nhỏ, phù hợp cho việc sử dụng trong các hệ thống quang học như máy chiếu và đèn chiếu sáng. Tuy nhiên, do khả năng sinh nhiệt cao, đèn halogen dễ bị ảnh hưởng bởi hơi ẩm, đặc biệt là khi thay đổi bóng đèn.
Xem thêm : Bánh Pani Puri là gì? Cách làm Pani Puri đơn giản ngay tại nhà
Một điểm mạnh của đèn halogen là chi phí thay thế thấp và tuổi thọ cao. Trung bình, đèn halogen có thời gian hoạt động khoảng 1000 giờ, với công suất khoảng 55 W. Tuy nhiên, đa số năng lượng tiêu thụ được chuyển thành nhiệt năng thay vì ánh sáng, làm giảm hiệu suất chiếu sáng của đèn.
Halogen free đồng nghĩa với việc gì?
- Không chứa halogen, Halogen Free hoặc Non-Halogen, theo quy định của tiêu chuẩn IEC 61249-2-21 là: hàm lượng brom và clo dưới 900ppm, và tổng hàm lượng brom và clo không vượt quá 1500ppm, khối lượng này không bao gồm halogen.
- Halogen free thường được sử dụng như chất chống cháy và dùng trong sản xuất thành phần điện tử và vật liệu, bên cạnh đó còn trong sản xuất vỏ sản phẩm, chất dẻo và các mục đích khác. Loại chất chống cháy này không thể tái chế, khi đốt cháy hoặc nung nó sẽ phát ra các chất gây hại. Điều này đe dọa sức khỏe con người, môi trường và cả thế hệ tương lai. Do đó, trong phạm vi hạn chế halogen, tất cả các quốc gia đang nỗ lực sử dụng các phương pháp tương ứng để giảm thiểu hiện tượng này, đó chính là halogenation.
Các Ứng Dụng của Iốt
- Thuốc bôi iốt (5% iốt trong nước/êtanol) được sử dụng trong tủ thuốc gia đình để khử trùng vết thương hoặc bề mặt chứa nước uống.
- Iốt-123 được sử dụng trong lĩnh vực y học để tạo ảnh và thực hiện các xét nghiệm về hoạt động của tuyến giáp.
- Iốt-131 là loại iốt được ứng dụng trong y học để điều trị ung thư tuyến giáp và các bệnh liên quan, cũng như sử dụng trong quá trình chụp ảnh tuyến giáp.
- Nguyên tố iốt (không hòa tan vào các hợp chất với các nguyên tố khác) được xem là có độc tính đối với mọi sinh vật.
### Câu hỏi thường gặp
-
Halogen là gì và lý thuyết về Halogen?
- Halogen là các nguyên tố phi kim thuộc nhóm VIIA.
-
Vị trí của nhóm Halogen trong bảng tuần hoàn là như thế nào?
- Nhóm Halogen gồm các nguyên tố flo (F), clo (Cl), brom (Br), iot (I) và atatin (At).
-
Cấu hình electron nguyên tử, cấu tạo phân tử của nhóm Halogen như thế nào?
- Lớp electron ngoài cùng của nguyên tử halogen đều có 7 electron.
-
Một số phản ứng minh họa tính chất của Halogen?
- Halogen phản ứng với hầu hết các kim loại trừ Au và Pt.
-
Tính chất vật lí và hóa học của nhóm Halogen là gì?
- Halogen có trạng thái và màu sắc khác nhau.
-
Halogen free là gì và các ứng dụng của nó?
- Halogen free không chứa brom và clo, được sử dụng trong các sản phẩm điện tử.
-
Halogen trong y học và ứng dụng của Iốt?
- Iốt được sử dụng trong các ứng dụng y khoa như chụp ảnh tuyến giáp.
-
Đèn halogen là gì và ứng dụng của nó?
- Đèn halogen là loại đèn sợi đốt được sử dụng trong máy chiếu và đèn chiếu sáng.
Tóm tắt
Bài viết trên cung cấp một cái nhìn tổng quan về nhóm Halogen, bao gồm thông tin về vị trí trong bảng tuần hoàn, cấu hình electron, các tính chất vật lí và hóa học, cũng như các ứng dụng trong y học và công nghiệp. Hy vọng rằng thông tin này sẽ giúp bạn hiểu rõ hơn về nhóm Halogen và ứng dụng của chúng trong cuộc sống hàng ngày. Để biết thêm chi tiết, hãy truy cập trang web của chúng tôi.
Nguồn: https://laginhi.com
Danh mục: News