Bạn đã bao giờ tự hỏi về Phản ứng hóa hợp chưa? Điều gì khiến cho phản ứng này xảy ra? Phản ứng hóa hợp có những đặc điểm và phân loại như thế nào? Và không thể bỏ qua các ví dụ thú vị về phản ứng hóa hợp trong thế giới tự nhiên. Hãy cùng tìm hiểu sâu hơn với Là Gì Nhỉ để khám phá nhé!
Khái niệm phản ứng hóa hợp
Phản ứng hóa hợp là quá trình hóa học mà trong đó một chất mới được hình thành bằng cách kết hợp hai hoặc nhiều chất khác nhau.
Bạn đang xem: Phản ứng hóa hợp là gì? Những phản ứng hóa hợp trong tự nhiên
Ví dụ: 2Na+ Cl2→ 2NaCl
4Fe+ 3O2→ 2Fe2O3
Đặc Điểm Phản Ứng Hóa Hợp
- Phản ứng hóa hợp có thể thay đổi số oxi hóa hoặc không tùy thuộc vào bản chất của các chất tham gia.
- Phản ứng kết thúc khi:
Một trong các chất tham gia phản ứng hết.
+ Đạt cân bằng hóa học: kcb=([c]^c[d]^d)/([a]^a[b]^b)
Trong hóa học, phản ứng hóa hợp có thể dẫn đến sự thay đổi số oxi hóa hoặc giữ nguyên số oxi hóa của các chất tham gia tùy thuộc vào bản chất của chúng. Quá trình này kết thúc khi ít nhất một trong các chất tham gia hoàn toàn tiêu thụ. Đồng thời, cân bằng hóa học được xác lập dựa trên tỷ lệ số mol của các chất tham gia và sản phẩm, được biểu diễn bằng công thức toán học kcb=([c]^c[d]^d)/([a]^a[b]^b).
Thông qua việc hiểu rõ đặc điểm của phản ứng hóa hợp, bạn sẽ có cơ hội áp dụng kiến thức này vào thực hành hóa học một cách hiệu quả và chính xác. Để đạt được kết quả tốt nhất, hãy nắm vững nguyên lý cơ bản của phản ứng này và áp dụng chúng vào các bài tập và thí nghiệm hóa học thực tế.
Điều kiện
Phản ứng hóa hợp xảy ra trong trường hợp ΔG âm.
Để xác định xem phản ứng có thể xảy ra hay không, chúng ta quan tâm đến các điều kiện sau:
- Điều kiện 1: ΔE = E∘OXH – E∘K > 0, dẫn đến ΔG = -nFΔE < 0.
- Điều kiện 2: ΔG = ΔH – TΔS < 0.
Môi Trường
Chất Kích Thích: một số phản ứng hóa học cần chất kích thích để xảy ra một cách hiệu quả và nhanh chóng:
Ví dụ: 2Al + 3I2 → H2O → 2AlI3
Xem thêm : Dư nợ là gì? 6 cách thanh toán dư nợ thẻ tín dụng
Nồng Độ: độ dày, nồng độ của các chất càng cao thì quá trình phản ứng diễn ra càng nhanh chóng.
Trạng thái hóa hợp với sự thay đổi số oxi hóa
Khi thực hiện phản ứng hóa hợp, ta quan sát sự biến đổi đáng chú ý về số oxi hóa của các chất tham gia như sau:
- Đơn chất + Đơn chất → Hợp chất
- Kim loại điển hình + Phi kim điển hình → Hợp chất ion
Ví dụ: Al + 3O2 → 2Al2O3
- Phi kim + Phi kim → Hợp chất cộng hóa trị
Ví dụ: S + O2 → SO2
- Đơn chất + Hợp chất → Hợp chất cộng hóa trị
Ví dụ: H2 + C2H4 → C2H6
- Hợp chất + Hợp chất → Hợp chất cộng hóa trị
Ví dụ: C2H4 + H2O → C2H5OH
Phản ứng hóa hợp không có sự thay đổi số oxi hóa
- Oxit bazơ + Oxit axit → Muối
CaO+ CO2→ CaCO3
- Oxit bazơ + Nước → Bazơ
Na2O+ H2O→ 2NaOH
- Oxit axit + Nước → Axit
SO3+H2O→ H2SO4
- Oxit axit + Bazơ → Muối axit
SO2+ KOH→ KHSO3
- Amoniac + Axit → Muối amoni
NH3+ H2SO4→ (NH4)2SO4
- Phản ứng tạo phức chất
Xem thêm : 1 g bằng bao nhiêu mg? Cách đổi g về các đơn vị đo khối lượng
Al2O3+ 2NaOH+ 3H2O→ 2Na[Al(OH)4]
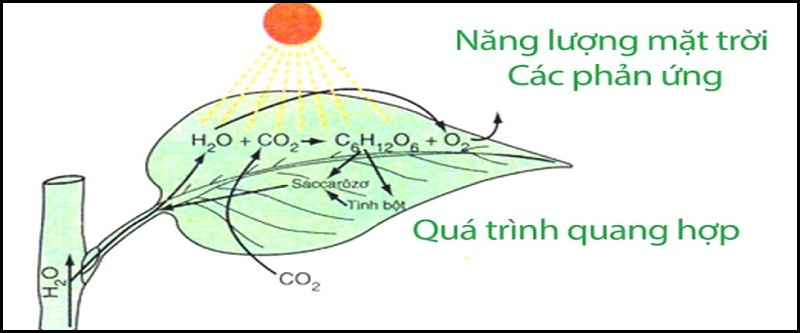
Phản ứng Quang Hợp
- Quang hợp là quá trình năng lượng ánh sáng Mặt Trời được diệp lục trong lục lạp hấp thụ để tạo ra cacbonhiđrat và ôxi từ khí cacbonic và nước.
- Đây cũng là quá trình oxi hóa khử trong đó H2O bị oxi hóa và CO2 bị khử.
- Phương trình tổng quát về phản ứng quang hợp: 6CO2 + 12H2O → C6H12O6 + 6O2
Phản ứng ăn mòn đá vôi
Khi sử dụng đá trong xây dựng, tải trọng thiết kế không thường gây hư hại, nhưng thường bị ảnh hưởng bởi quá trình ăn mòn. Nguyên nhân chính gây ra sự hư hại này bao gồm:
- Môi trường nước có hàm lượng khí cacbonic cao (trên 35mg/l) sẽ kích hoạt phản ứng hóa học:
CaCO3 + H2O + CO2 → Ca(HCO3)2. Vì Ca(HCO3)2 dễ tan, do đó đá dần bị ăn mòn.
- Môi trường nước có chứa axit cũng gây ra phản ứng hóa học:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O.
Các hiện tượng ăn mòn thường xảy ra đối với các loại đá cacbonat.
- Đá chứa nhiều loại khoáng vật khác nhau có thể bị hư hại nhanh hơn do sự giãn nở không đồng đều.
- Các loại bụi và chất thải / gốc hữu cơ và vô cơ từ công nghiệp hoặc sinh hoạt tăng tích tụ trên bề mặt hoặc trong các khe hở của đá tạo môi trường cho vi khuẩn phát triển và gây hư hại bằng axit chúng tỏa ra.

Phản ứng hóa hợp là gì? Điều kiện xảy ra phản ứng hóa hợp? Đặc điểm và cách phân loại của phản ứng hóa hợp như nào? Những ví dụ về phản ứng hóa hợp trong tự nhiên? Trong bài viết sau đây, hãy cùng tìm hiểu nhé!
Câu hỏi thường gặp
-
Phản ứng hóa hợp là gì?
- Phản ứng hóa hợp là quá trình hóa học tạo ra một chất mới từ hai hoặc nhiều chất ban đầu.
-
Điều kiện xảy ra phản ứng hóa hợp là gì?
- Phản ứng hóa hợp xảy ra khi ΔG < 0 hoặc khi ΔG = ΔH – TΔS < 0.
-
Phân loại phản ứng hóa hợp như thế nào?
- Phản ứng hóa hợp có thể được phân loại thành có sự thay đổi số oxi hóa và không có sự thay đổi số oxi hóa.
-
Có ví dụ nào về phản ứng hóa hợp trong tự nhiên không?
- Phản ứng quang hợp và phản ứng ăn mòn đá vôi là hai ví dụ phản ứng hóa hợp trong tự nhiên phổ biến.
Tóm tắt
Trên đây là những kiến thức cơ bản xoay quanh phản ứng hóa hợp. Để hiểu sâu hơn về chủ đề này, hãy truy cập trang web để đọc thêm thông tin chi tiết. Hãy cùng khám phá và tìm hiểu những điều thú vị về phản ứng hóa hợp để mở rộng kiến thức của mình.
Nguồn: https://laginhi.com
Danh mục: News
