Phản ứng trung hòa là một khái niệm quan trọng không thể bỏ qua trong môn hóa học ở cấp Trung học cơ sở. Để giúp bạn hiểu rõ hơn về chủ đề này, Laginhi.com sẽ cung cấp đến bạn một cái nhìn tổng quan về phản ứng trung hòa cùng với cách phân loại và bài tập thú vị.
Định nghĩa phản ứng trung hòa
Phản ứng trung hòa là quá trình mà 1 axit và 1 bazơ phản ứng với nhau sao cho sau khi hoàn thành, dung dịch thu được (bao gồm muối và nước) không còn có tính chất axit hoặc bazơ nữa, tức là số mol axit bằng số mol bazơ trong phản ứng.
Bạn đang xem: Phản ứng trung hòa là gì? Định nghĩa, Cách phân loại và Bài tập
Điều Kiện Phản Ứng Trung Hòa
- Phản ứng trung hòa được xem như một dạng phản ứng trao đổi, do đó điều kiện để phản ứng trung hòa xảy ra cũng chính là điều kiện để phản ứng trao đổi diễn ra.
- Phản ứng trao đổi trong dung dịch các chất chỉ xảy ra khi sản phẩm hình thành bao gồm chất không tan, khí hoặc nước.
Điều quan trọng của bất kỳ phản ứng hóa học nào là điều kiện cần thiết để chúng diễn ra. Trong trường hợp của phản ứng trung hòa, điều này càng trở nên quan trọng hơn bởi tính chất đặc biệt của việc cân bằng các ion. Đối với nhiều phản ứng trung hòa, việc tạo thành sản phẩm có thể kết tủa hoặc là chất kích thích quá trình trao đổi ion là yếu tố quan trọng quyết định khả năng xảy ra của phản ứng.
Trong ngữ cảnh hóa học, sự hiểu biết về điều kiện và cơ chế phản ứng trung hòa không chỉ giúp bạn hiểu rõ hơn về cấu trúc và tính chất của các chất mà còn có thể ứng dụng vào nhiều lĩnh vực khác nhau. Điều này thực sự là một phần quan trọng của đào tạo và hiểu biết trong lĩnh vực khoa học.
Ví dụ về phản ứng trung hòa
Phản ứng trung hòa là hiện tượng hóa học quan trọng, trong đó các chất hoá học tương tác để tạo ra các sản phẩm mới. Ví dụ, khi các chất CuSO4 và NaOH phản ứng, chúng tạo thành Na2SO4 và Cu(OH)2. Tuy nhiên, khi K2SO4 và NaOH tương tác, phản ứng sẽ không xảy ra do các yếu tố khác nhau. Điều này là ví dụ minh họa cho sự đa dạng và phức tạp của các phản ứng hóa học.
Để hiểu rõ hơn về cơ chế và ứng dụng của phản ứng trung hòa, hãy theo dõi các ví dụ và bài giảng chi tiết hơn về chủ đề này. Qua việc nghiên cứu và áp dụng kiến thức này trong thực tế, bạn sẽ có cái nhìn sâu hơn về sự phức tạp và tính ứng dụng của hóa học.
Ở mỗi ví dụ, sự tương tác giữa các chất hóa học đều là một cơ hội để khám phá và hiểu biết sâu hơn về thế giới không gian ngầm của phản ứng hóa học. Bằng cách tìm hiểu và áp dụng kiến thức này, bạn sẽ trở thành một chuyên gia trong lĩnh vực này và có thể áp dụng kiến thức đó vào thực tế một cách hiệu quả.
Hãy tiếp tục tìm hiểu, nghiên cứu và khám phá về các phản ứng hóa học, đồng thời áp dụng kiến thức đó vào thực tế một cách linh hoạt và sáng tạo. Điều này sẽ giúp bạn phát triển kỹ năng và kiến thức, từ đó trở thành một chuyên gia uy tín và đáng tin cậy trong lĩnh vực hóa học.
Hiệu ứng nhiệt của phản ứng trung hòa
Thí nghiệm: Đo lường hiệu ứng nhiệt của phản ứng trung hòa giữa NaCl và NaOH
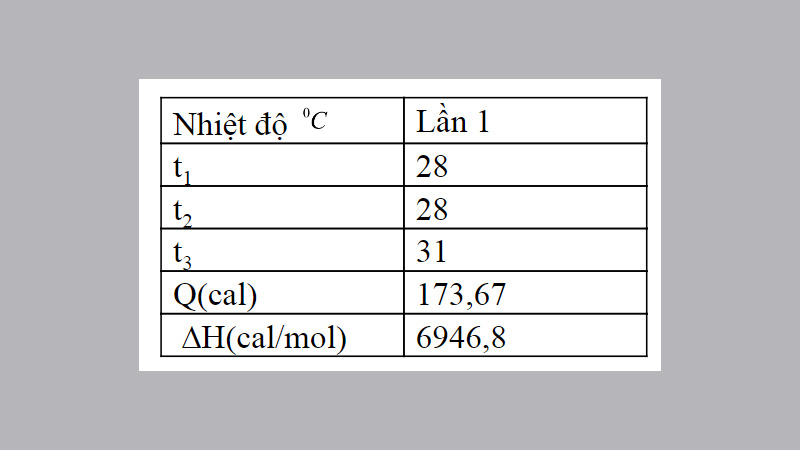
Nếu nhiệt độ t1 không bằng t2, thì sự thay đổi nhiệt độ Δt được tính bằng sự chênh lệch giữa t3 và (t1+t2)/2
Trong phép thử này, chúng ta tính được:
- Q = (m0c0 + mHClcHCl + mNaClcNaCl) (t3 – (t1 + t2) / 2)
- Q = (7,89 + 25 + 25) (31 – (28 + 28) / 2) = 173,67 cal
Nguyên lý của phản ứng trung hòa
- Khi thực hiện một phản ứng trung hòa với lượng axit và bazơ bằng nhau (đo bằng mol), sau khi phản ứng hoàn tất, chỉ thu được một loại muối, không còn axit hoặc bazơ dư thừa.
- Đặc điểm quan trọng của các phản ứng axit-bazơ chính là chỉ số pH, biểu thị mức độ axit hoặc bazơ của dung dịch, dựa trên nồng độ ion H+ có trong dung dịch.
- Theo quan điểm của Bronsted và Lowry, axit được xem là chất có khả năng nhường proton (H+), còn bazơ là chất có khả năng nhận proton.
Axit mạnh + bazơ mạnh
Trong ví dụ này, chúng ta sẽ xem xét phản ứng giữa axit sunfuric và kali hydroxit trong nước:
H2SO4 + 2KOH → K2SO4 + 2H2O
Đây là một phản ứng giữa một axit mạnh và một bazơ mạnh. Cả axit và bazơ đều ion hóa hoàn toàn trong dung dịch, dẫn đến độ pH của dung dịch phụ thuộc vào chất điện ly chiếm tỷ lệ lớn hơn.
Axit mạnh + bazơ yếu
Dung dịch axit nitric (HNO3) pha loãng phản ứng với khí ammonia (NH3), tạo ra muối amon nitrat (NH4NO3), trong đó nước được tạo ra nhưng không được quan sát trực tiếp. Phản ứng có thể được biểu diễn như sau:
Xem thêm : Ăn mày quá khứ là gì? Tại sao lại thích ăn mày quá khứ?
HNO3 + NH4+ + OH− → NH4NO3 + H2O
Do đó, nước có thể được coi là một sản phẩm của phản ứng. Trong trường hợp này, dung dịch sẽ có độ kiềm hóa do sự hiện diện của axit nitric mạnh và bazơ yếu.
Axit yếu + bazơ mạnh
Trong phản ứng giữa axit axetic với natri hidroxit, CH3COOH+ NaOH→ CH3COONa+ H2O, do axit axetic có tính chất điện li yếu, chỉ phân ly một phần, dẫn đến sự hình thành của natri axetat và nước. Kết quả, dung dịch sẽ có pH cơ bản, thể hiện tính bazơ của sản phẩm.
Axit yếu + bazơ yếu
Kết luận cuối cùng và như đã đề cập ở trên, khi hòa trộn một axit yếu với một bazơ yếu, không thể xảy ra sự trung hòa. Không có hiện tượng tương tự xảy ra. Cả hai chất đều trải qua quá trình thủy phân trong dung dịch nước, ảnh hưởng đến độ pH của dung dịch, phụ thuộc vào “độ bền” của axit và bazơ.
Ví dụ về phản ứng trung hòa
Một minh chứng điển hình cho hiện tượng trung hòa là khi axit và bazơ tương tác với nhau tạo ra muối và nước theo phản ứng: axit + bazơ → muối + nước
Ví dụ: HCl+ NaOH→ NaCl+ H2O
Dấu mũi tên chỉ ra rằng phản ứng đã hoàn tất và sản phẩm đã được tạo ra. Mặc dù ví dụ truyền thống này là hợp lý, một biểu thức tổng quát dựa trên lý thuyết axit-bazơ Bronsted-Lowry được phát triển: AH+ B→ A+ BH
Dưới đây là một số ví dụ phổ biến về phản ứng trung hòa:
- Ca(OH)2+H2SO4→ CaSO4+ 2H2O
- 6HCl+ CO2→ CaCO3+ H2O
- Cu(OH)2+H2SO4→ CuSO4+ 2H2O
- HCl+ KOH→ KCl+ H2O
- Ca(HCO3)2+ H2SO4→ 2H2O+ 2CO2+ CaSO4
Bạn đã hiểu về cách phản ứng trung hòa diễn ra và cách các chất tương tác để tạo ra sản phẩm mới.
Lý Thuyết Cần Nhớ
Trong hóa học, axit đơn bao gồm các chất như HCl, HBr, HI, HNO3, với quy tắc nH= naxit.
Axit đa thường là H2SO4, H3PO4, H2SO3, với quy tắc nH= 2naxit hoặc nH= 3naxit.
Bazơ đơn thường gặp gồm KOH, NaOH, LiOH, với mối quan hệ nOH= nbazo.
Bazơ đa bao gồm Ba(OH)2, Ca(OH)2, với quy tắc nOH= 2nbazo.
Trong phản ứng trung hòa, ta có PTHH: H+ + OH− → H2O.
Phương pháp giải
Bước 1: Viết ra các Phương trình Hoá học xảy ra.
Xem thêm : Nui là gì? Bao nhiêu calo, ăn có tốt không? Các món nui ngon
Bước 2: Đặt ẩn số nếu đề bài là hỗn hợp.
Bước 3: Lập phương trình toán học.
Bước 4: Giải phương trình toán học, xác định ẩn số.
Bước 5: Thực hiện tính toán theo yêu cầu của đề bài.
Lưu ý:
- Khi đối mặt với dung dịch hỗn hợp chứa axit phản ứng với dung dịch hỗn hợp chứa bazơ, sử dụng phương pháp đặt công thức tương đương cho axit và bazơ.
- Đặt thể tích dung dịch cần tìm là V (đơn vị: lít).
- Đề cương quan trọng: số mol axit = số mol bazơ.
Kiến thức về phản ứng trung hòa là một trong những chủ đề quan trọng của hóa học ở cấp trung học cơ sở. Trong bài viết này, chúng ta sẽ cùng tìm hiểu chi tiết về chủ đề này.
FAQs
Dưới đây là 12 câu hỏi liên quan đến phản ứng trung hòa cùng với câu trả lời tương ứng:
-
Phản ứng trung hòa là gì?
- Phản ứng trung hòa là sự phản ứng giữa axit và bazơ để tạo ra muối và nước, không còn tính axit hoặc bazơ sau khi phản ứng kết thúc.
-
Phản ứng trung hòa xảy ra dưới điều kiện nào?
- Phản ứng trung hòa xảy ra trong điều kiện phản ứng trao đổi, khi sản phẩm tạo thành không tan hoặc là chất khí hoặc nước.
-
Cung cấp ví dụ về phản ứng trung hòa.
- Ví dụ: CuSO4 + 2NaOH → Na2SO4 + Cu(OH)2.
-
Hiệu ứng nhiệt của phản ứng trung hòa như thế nào?
- Nếu t1 ≠ t2 thì Δt tính bằng hiệu số giữa t3 và (t1+t2)/2. Công thức tính: Q = (m0c0 + mHClcHCl + mNaClcNaCl)(t3-(t1+t2)/2).
-
Nguyên lý của phản ứng trung hòa là gì?
- Trong phản ứng trung hòa, nếu bắt đầu với lượng axit và bazơ bằng nhau (tính bằng mol), khi kết thúc chỉ thu được một muối mà không còn axit hoặc bazơ.
… và thêm 7 câu hỏi khác với câu trả lời chi tiết tại DINHNGHIA.COM.VN.
Tóm tắt
Bài viết đã cung cấp cái nhìn toàn diện về phản ứng trung hòa trong hóa học. Qua việc tìm hiểu về định nghĩa, ví dụ, hiệu ứng nhiệt, nguyên lý, cách phân loại và bài tập thực hành, chúng ta có thể hiểu rõ hơn về cơ chế hoạt động và ứng dụng của phản ứng này. Để biết thêm thông tin chi tiết và thực hành các bài tập, hãy truy cập DINHNGHIA.COM.VN ngay hôm nay!
Nguồn: https://laginhi.com
Danh mục: News
