Là Gì Nhỉ – Được biết đến với tính chính xác và sự đa dạng, liên kết ion đã trở thành một chủ đề hấp dẫn trong ngành khoa học. Không chỉ là một khái niệm đơn giản, mà liên kết ion còn mang trong mình những bí ẩn đáng khám phá. Sự hình thành của liên kết ion giữa các hạt mang điện tích đã thu hút sự quan tâm của rất nhiều nhà nghiên cứu.
Vậy, liên kết ion là gì chính xác? Tại sao nó quan trọng đến vậy? Hãy cùng khám phá và so sánh giữa liên kết ion và liên kết cộng hóa trị để hiểu rõ hơn về sự độc đáo của chúng. Chúng ta sẽ cũng thực hành qua các bài tập để nhận biết dấu hiệu cho thấy phân tử có liên kết cộng hóa trị. Hãy cùng tìm hiểu sâu hơn về liên kết ion và những liên kết khác thông qua những kiến thức bổ ích dưới đây.
Bạn đang xem: Liên kết ion là gì? Tìm hiểu sự hình thành liên kết ion
Khái niệm liên kết ion là gì?
Theo định nghĩa, liên kết ion (liên kết điện tích) là một dạng liên kết với bản chất là lực hút tĩnh điện giữa hai loại ion mang điện tích trái dấu. Thông thường, liên kết điện tích xảy ra giữa các nguyên tử nguyên tố phi kim với nguyên tử của nguyên tố kim loại.
Để hiểu rõ hơn về khái niệm liên kết ion, chúng ta cần tìm hiểu về cơ chế hoạt động và ý nghĩa của quá trình này. Liên kết ion đóng vai trò quan trọng trong hóa học và định nghĩa cách mà các nguyên tử tương tác với nhau. Bằng cách này, chúng ta có thể thấy cách mà thế giới nguyên tử hoạt động và tương tác để tạo ra các hợp chất phức tạp.
Một điểm đáng chú ý là liên kết ion thường xảy ra giữa nguyên tử mang điện tích dương và nguyên tử mang điện tích âm. Sự tương tác giữa hai loại ion này tạo ra sự ổn định bằng cách tạo ra cấu trúc tinh thể có thứ tự, góp phần quan trọng vào tính chất của các hợp chất ion.
Trong quá trình liên kết ion, không gian electron của mỗi ion sẽ được cân bằng để tạo ra một cấu trúc ổn định hơn. Điều này làm cho liên kết ion trở thành một phần quan trọng của hóa học hữu cơ và không cơ học. Việc hiểu rõ về khái niệm này sẽ giúp bạn thấu hiểu sâu hơn về thế giới nguyên tử và tương tác giữa chúng.
Ion là gì?
Trong thế giới nguyên tử, mỗi nguyên tử đều có số proton bằng số electron, tạo nên sự cân bằng về điện tích. Tuy nhiên, trong các phản ứng hóa học, khi một nguyên tử mất hoặc nhận thêm electron, nó sẽ chuyển thành một phân tử mới mang theo điện tích dương hoặc âm, và được gọi là ion.
Ion dương (hay cation)
- Trong quá trình hình thành ion natri từ nguyên tử liti: Nguyên tử liti có cấu hình electron: (1s^{2}2s^{1}) có năng lượng hóa (I_{1}) thấp, dẫn đến việc dễ mất một electron ở lớp ngoài cùng để trở thành ion mang một đơn vị điện tích dương. Quá trình này có thể được diễn giải như sau: (Li rightarrow Li^{+} + e)
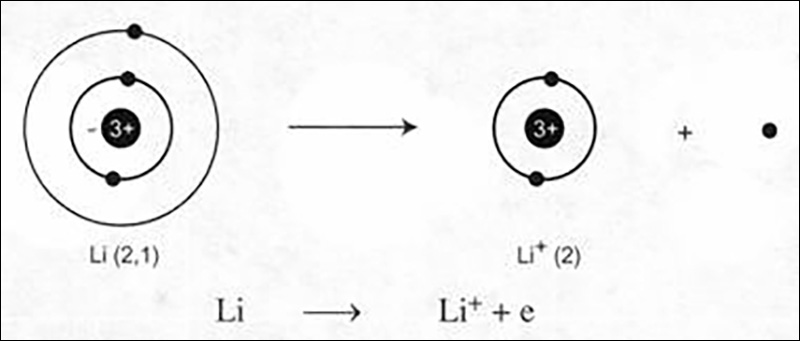
- Các nguyên tử kim loại thường dễ nhường 1, 2, 3 electron ở lớp ngoài cùng để trở thành các ion mang 1, 2, 3 đơn vị điện tích dương. Ví dụ:
(Mg rightarrow Mg^{2+} + 2e)
(Al rightarrow Al^{3+} + 3e)
- Ion dương hay cation là thuật ngữ chỉ đến các ion mang điện tích dương. Đặc điểm chung của chúng là mất electron để trở thành dương tính. Cation của kim loại thường được đặt tên bằng cách thêm từ “cation” vào phía trước tên của kim loại, ví dụ như cation liti (Li^{+}), cation magiê (Mg^{2+}), cation nhôm (Al^{3+}), cation đồng II (Cu^{2+}).
Ion âm (hay anion)
- Ta xét sự hình thành ion flo từ nguyên tử flo: Nguyên tử flo có cấu hình electron: (1s^{2}2s^{2}2p^{5}) và có độ âm điện lớn nên flo dễ thu thêm một electron để trở thành ion mang một đơn vị điện tích âm. Ta có thể biểu diễn quá trình đó như sau:
(F + e rightarrow F^{-})
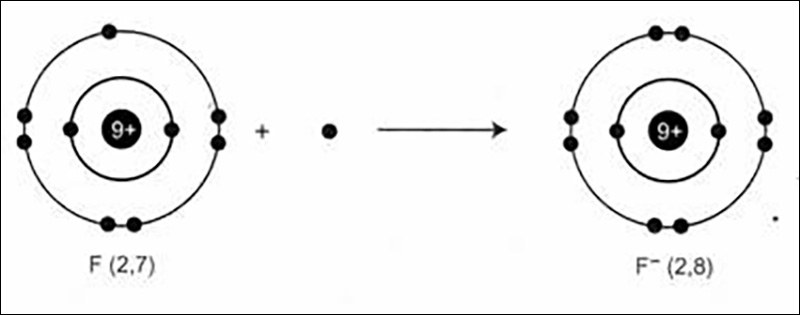
- Các nguyên tử halogen khác và các nguyên tử phi kim như O, S có thể thu thêm 1, 2 electron và trở thành các ion âm. Ví dụ:
(Cl + e rightarrow Cl^{-})
Xem thêm : Apple Prores là gì? Có gì khác biệt với các trình nén video khác
(O + 2e rightarrow O^{2-})
(S + 2e rightarrow S^{2-})
- Ion mang điện tích âm được gọi là ion âm hay anion. Người ta thường gọi tên các anion bằng tên gốc axit tương ứng, ví dụ: các ion (F^{-}, Cl^{-}, S^{2-}) lần lượt được gọi là ion florua, clorua, sunfua. Ion (O^{2-}) được gọi là ion oxit.
Quy tắc bát tử
Các nguyên tử của các nguyên tố có khuynh hướng liên kết với các nguyên tử khác để đạt được cấu hình bền vững của khí hiếm với 8 electron (hoặc của Heli với 2 electron) ở lớp ngoài cùng.
Ion đơn và ion đa nguyên tử
Ion đơn nguyên tử là loại ion được hình thành từ một nguyên tử duy nhất. Ví dụ:
- (Li^{+},Mg^{2+},Al^{3+},Cu^{2+},F^{-},Cl^{-},S^{2-},…)
Ion đa nguyên tử là loại ion được tạo ra bằng cách kết hợp nhiều nguyên tử với nhau để tạo thành một nhóm nguyên tử với điện tích dương hoặc âm. Ví dụ:
- Ion amoni ((NH_{4}^{+})), các ion gốc axit như ion nitrat ((NO_{3}^{-})), ion sunfat ((SO_{4}^{2-})), ion photphat ((PO_{4}^{3-}))
Sự hình thành liên kết ion
- Liên kết ion là kết nối được tạo ra thông qua sức hút điện giữa các ion mang điện tích trái dấu.
- Đây là loại liên kết thường xuất hiện giữa kim loại và phi kim.
Tạo Liên Kết Ion Giữa Hai Nguyên Tử
Khi xem xét việc tạo ra liên kết ion trong phân tử natri clorua (NaCl), ta nhận thấy do cấu tạo nguyên tử và theo quy tắc bát tử, khi các nguyên tử Na và Cl tiếp xúc, chúng sẽ trao đổi electron để tạo ra các ion (Na^{+}, Cl^{-}). Các ion này có cấu hình electron tương tự như các khí hiếm Ne và Ar. Sự hình thành các ion (Na^{+}, Cl^{-}) với điện tích trái dấu này tạo ra một lực hút, tạo nên liên kết trong phân tử và tinh thể NaCl.
Sự hình thành liên kết ion trong phân tử NaCl có thể được minh họa như sau:
- Hai ion với điện tích ngược dấu sẽ tương tác qua lực hút tĩnh điện, tạo ra phân tử NaCl:
(Na^{+} + Cl^{-} rightarrow NaCl)
Tính chất liên kết ion trong phân tử đa nguyên tử
- Giống như việc hình thành phân tử NaCl, quá trình hình thành liên kết trong phân tử (CaCl2) được mô tả qua sơ đồ dưới đây:
- Các ion (Ca2+, Cl–) có điện tích trái dấu sẽ tương tác thông qua lực hút tĩnh điện, kết hợp thành phân tử (CaCl2):
(Ca2+ + 2Cl– → CaCl2)
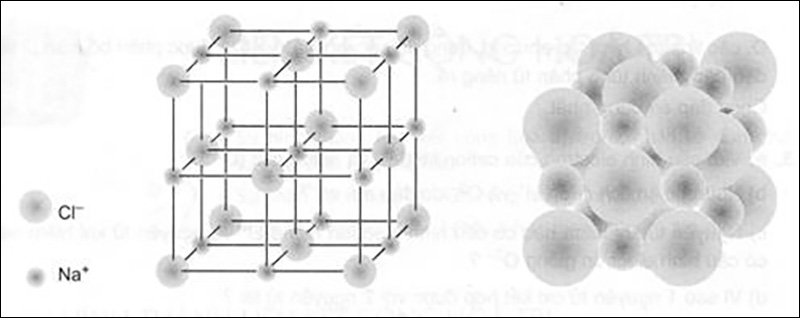
Tinh Thể NaCl
Xem thêm : Hạt macca là gì? Thành phần dinh dưỡng và công dụng hạt macca
Trạng thái rắn của NaCl được thấy qua cấu trúc tinh thể ion. Trong lưới tinh thể NaCl, các ion (Na^{+}, Cl^{-}) được phân bố đều trên các đỉnh của các hình lập phương nhỏ một cách xen kẽ. Mỗi ion được bao quanh bởi 6 ion cùng dấu gần nhất.
Tính chất chung của hợp chất ion
Hợp chất ion thường mang tính ổn định cao, rắn chắc, khó tan chảy và bay hơi do sức hút điện mạnh mẽ giữa các ion trái dấu bên trong tinh thể ion. Ví dụ, NaCl có nhiệt độ nóng chảy ở (800^{circ}C), trong khi MgO là (2800^{circ}C). Các hợp chất ion thường tan tan trong nước và dẫn điện khi tan hoặc ở dạng chảy, nhưng không dẫn điện ở trạng thái rắn.
Định Nghĩa Liên Kết Cộng Hóa Trị là Gì?
Liên kết cộng hóa trị là sự hình thành một liên kết giữa hai nguyên tử thông qua việc chia sẻ một hoặc nhiều cặp electron.
Trong hóa học, liên kết cộng hóa trị là một khái niệm quan trọng và phổ biến, đóng vai trò critical trong việc xác định cấu trúc và tính chất của các phân tử và hợp chất hóa học.
Tính Chất Của Liên Kết Cộng Hóa Trị
- Liên kết cộng hóa trị thường xảy ra giữa các nguyên tử phi kim trong việc chia sẻ electron.
- Sự chia sẻ electron trong liên kết cộng hóa trị tạo ra một môi trường ổn định cho các nguyên tử tham gia.
- Đặc điểm quan trọng của liên kết cộng hóa trị là khả năng tạo ra các phân tử và hợp chất phức tạp.
Bản Chất Và Vai Trò Của Liên Kết Cộng Hóa Trị
Liên kết cộng hóa trị không chỉ giữ các nguyên tử lại với nhau mà còn quyết định tính chất hóa học của các phân tử và chất lượng của vật liệu xây dựng từ chúng.
Điều này thú vị, từ quá trình liên kết cộng hóa trị đơn giản nhất cho đến những phức tạp như polymer, chúng đều đóng vai trò quan trọng trong môi trường sống và ngành công nghiệp.
Với mỗi liên kết cộng hóa trị, đều chứa đựng những thông tin quý giá về tính chất và cấu trúc của vật liệu hóa học, mở ra cơ hội khám phá sâu hơn về thế giới không gian nhỏ nhất mà chúng ta xung quanh.
Điều kiện hình thành liên kết cộng hóa trị
Các nguyên tử có cấu trúc tương đồng hoặc gần giống nhau sẽ tạo thành liên kết cộng hóa trị thông qua việc chia sẻ electron hóa trị. Ví dụ: (Cl_{2}, H_{2}, N_{2}, HCl, H_{2}O…)
Dấu hiệu phân biệt giữa phân tử đơn chất và hợp chất
- Phân tử đơn chất được tạo thành từ nguyên tố phi kim. Ví dụ như các phân tử (O_{2}, H_{2}, N_{2}, F_{2}…) đều có liên kết cộng hóa trị, là sự kết hợp giữa hai nguyên tử cùng một loại phi kim.
- Phân tử hợp chất được tạo thành từ các nguyên tố phi kim khác nhau. Ví dụ như các phân tử (F_{2}O, HF, H_{2}O, NH_{3}, CO_{2}…) cũng có liên kết cộng hóa trị, là kết hợp giữa hai nguyên tử phi kim khác nhau.
Liên kết cộng hóa trị có cực và không cực
- Khi electron cùng sử dụng được phân bố đối xứng giữa hai hạt nhân nguyên tử trong quá trình hình thành liên kết, đó là dạng liên kết cộng hóa trị không phân cực.
- Khi electron cùng sử dụng bị lôi kéo về phía nguyên tử có độ âm điện cao hơn, dẫn đến sự không cân đối trong phân bố electron, thì đó là loại liên kết cộng hóa trị có cực.
Liên kết ion là gì? Sự hình thành liên kết ion có gì đặc biệt? So sánh liên kết ion và liên kết cộng hóa trị? Bài tập liên kết ion và liên kết cộng hóa trị? Dấu hiệu cho thấy phân tử có liên kết cộng hóa trị? Trong phạm vi bài viết dưới đây, cùng tìm hiểu liên kết ion là gì cùng những nội dung liên quan.
Câu hỏi thường gặp về liên kết ion:
-
Liên kết ion là khái niệm gì?
Liên kết ion là sự tạo ra lực hút tĩnh điện giữa hai ion trái dấu, thường xảy ra giữa nguyên tử kim loại và phi kim. -
Làm thế nào để hình thành ion dương?
Nguyên tử kim loại dễ nhường electron ở lớp ngoài cùng, tạo thành ion dương hoặc cation. -
Hãy nêu ví dụ về ion dương?
Ví dụ: Na+ (natri), Mg2+ (magiê), Al3+ (nhôm). -
Ion âm được hiểu như thế nào?
Ion âm thường là phi kim, như F- (flo), Cl- (clorua), S2- (sunfua). -
So sánh liên kết ion và liên kết cộng hóa trị?
Liên kết ion hình thành giữa các ion trái dấu, trong khi liên kết cộng hóa trị là sự chia sẻ electron giữa hai nguyên tử. -
Tại sao tinh thể ion rất bền vững?
Tinh thể ion bền vững vì lực hút tĩnh điện giữa các ion đối dấu rất mạnh. -
Ion đơn và ion đa nguyên tử khác nhau như thế nào?
Ion đơn gồm một nguyên tử, còn ion đa nguyên tử bao gồm nhiều nguyên tử liên kết lại với nhau. -
Tính chất chung của hợp chất ion là gì?
Hợp chất ion thường tan nhiều trong nước và có nhiệt độ nóng chảy cao. -
Liên kết cộng hóa trị có cực và không cực khác nhau thế nào?
Liên kết cộng hóa trị không phân cực khi electron dùng chung phân bố đối xứng, còn có cực khi electron bị hút lệch về nguyên tử có độ âm điện cao hơn. -
Dấu hiệu cho thấy phân tử có liên kết cộng hóa trị là gì?
Dấu hiệu bao gồm sự hình thành phân tử đơn chất từ phi kim và phân tử hợp chất từ các phi kim khác nhau. -
Tác dụng của quy tắc bát tử trong liên kết ion là gì?
Quy tắc bát tử giúp nguyên tử đạt cấu hình electron bền vững của khí hiếm, cũng như làm tăng tính bền vững của liên kết ion. -
Hình dạng của tinh thể NaCl như thế nào?
Tinh thể NaCl có cấu trúc lập phương, với các ion natri và clorua xen kẽ nhau trên các đỉnh của hình lập phường đều.
Tóm tắt:
Trong bài viết này, chúng ta đã tìm hiểu về liên kết ion, cách hình thành ion, và sự khác biệt giữa liên kết ion và liên kết cộng hóa trị. Hiểu rõ về các khái niệm này sẽ giúp bạn nắm vững về cấu trúc và tính chất của các hợp chất hóa học. Hãy áp dụng kiến thức này vào thực tế và luôn tiếp tục học hỏi để phát triển bản thân.
Nếu bạn muốn tìm hiểu thêm về chủ đề này hoặc có bất kỳ câu hỏi nào khác, hãy truy cập website của chúng tôi ngay hôm nay để có thêm thông tin chi tiết.
Nguồn: https://laginhi.com
Danh mục: News


